La microscopie plénoptique : une imagerie volumétrique instantanée en post-traitement.
L’imagerie à trois dimensions est essentielle pour l’observation d’échantillons biologiques ou de composants industriels. Le volume est obtenu en déplaçant axialement l’échantillon ce qui peut être critique pour les systèmes biologiques immergés dans des milieux aqueux et qui ne peuvent pas être immobiles lorsque l’échantillon est déplacé. C'est le cas des organoïdes, qui sont des agrégats multicellulaires et qui miment certaines fonctions des organes in vitro. Dans ce contexte, la microscopie plénoptique (LFM) est une alternative intéressante car elle offre une imagerie 3D instantanée grâce à l'insertion d'un réseau de microlentilles dans le plan image d'un microscope.

Introduit en photographie en 2004, la technologie plénoptique consiste à capturer la direction de la distribution de la lumière qui arrive sur un capteur. L’idée de base est d’imager avec un réseau de capteurs la même chose mais avec un point de vue différent : on récupère ainsi les informations spatiales et angulaires de l’échantillon pour reconstruire une vue volumétrique. Ainsi il est possible, en post-traitement, de faire une mise au point numérique de notre image selon le plan optique désiré. En microscopie, au lieu d’utiliser un réseau de capteurs, on utilise un réseau de microlentilles (élément optique avec des lentilles de tailles micrométriques de l’ordre de 100 microns) qui va collecter optiquement les informations spatiales et angulaires et un seul capteur.
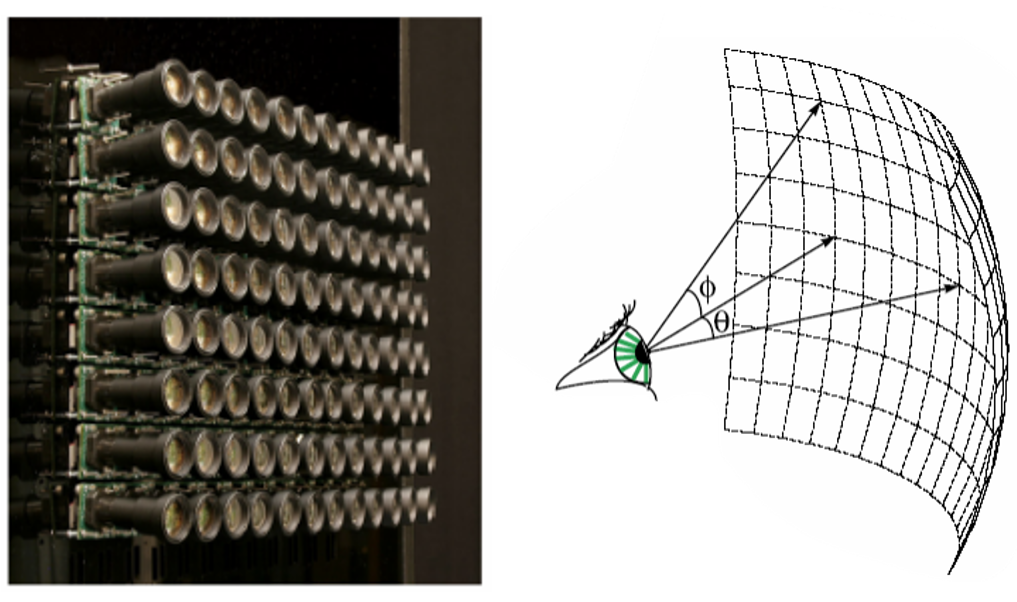
Figure 1. Réseau de capteurs pour la photographie
En microscopie, lorsqu’on image un échantillon, la caméra est placée dans le plan image du microscope mais en microscopie plénoptique c’est la microlentille qui est placée dans ce plan et on place la caméra derrière. Les images brutes plénoptiques sont des images en 4 dimensions : les informations directionnelles (u,v) des rayons incidents provenant de chaque microlentille (s,t) permettant de stocker les informations angulaires et spatiales en une image. Ainsi en sélectionnant les pixels (ui,vi) situés derrière les microlentilles, nous pouvons sélectionner les différents rayons de lumière à travers l’objectif qui correspondent donc à une perspective et ainsi extraire le point de vue de l’échantillon désiré. Ainsi en collectant de multiples perspectives il est possible, en post-traitement, reconstruire des vues en 3D de nos échantillons sans avoir à bouger physiquement l’objet de manière instantanée.
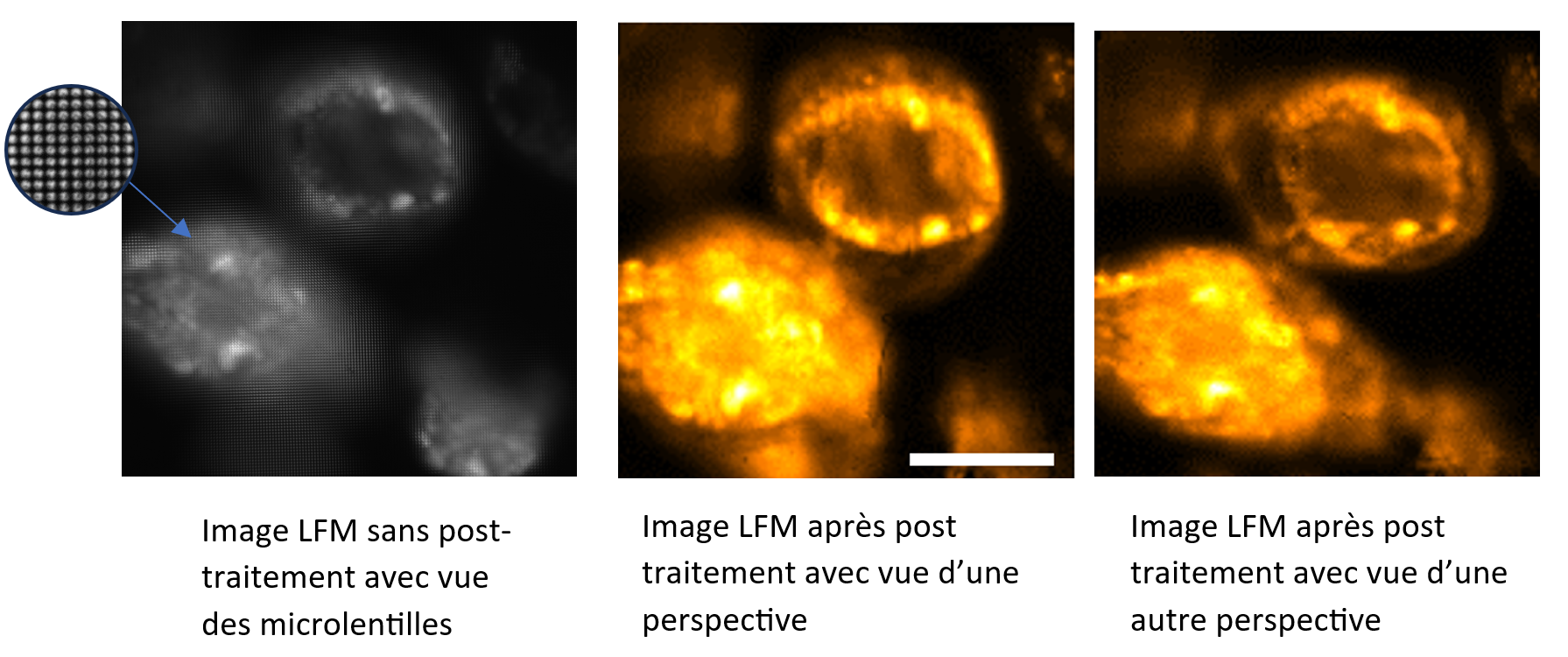
Figure 2. Images plénoptique de cellules Caco-2 (agrégats de cellules cancéreuses intestinales avec marqueurs fluorescents). Echelle : 100 μm.
Les techniques d’imagerie 3D en microscopie ont toutes leurs avantages mais aussi des inconvénients. La microscopie classique, par exemple, possèdent une très bonne résolution ainsi qu’un bon contraste mais malheureusement, la technique n’est pas instantanée et requiert de bouger l’échantillon physiquement pour obtenir une vue volumétrique de l’objet ce que l’on veut à tout prix éviter en biologie. L’imagerie plénoptique ne déroge pas à la règle, la limite de résolution du LFM est donnée par la taille des microlentilles. Ce que l’on gagne en information angulaire (avoir plus de perspectives pour obtenir une vue en 3 dimensions), on le perd en informations spatiales (capacité à distinguer deux éléments entre eux), c’est donc un compromis qu’il faut respecter lorsqu’on fait de l’imagerie. La profondeur d’imagerie aussi est une autre limitation, lorsqu’on image des échantillons transparents tout se passe bien mais si l’on souhaite imager des objets dans des milieux diffus, il peut être utile d’utiliser des filtres ou des outils numériques pour contourner cette autre limitation, ce qui sont les principaux objectifs de ma thèse.
Références :
1-Marc Levoy et al, 2006, Standford University, Light Field Microscopy.
2-Chenqgiang Yi et al, 2022, National Laboratory for Optoelectronics Huazhong University of Science and Technoloy, Light Field Microscopy in biological Imaging.
3-Lanxin Zhu, 2023, A practical guide to deep-learning light-field microscopy for 3D imaging of biological dynamics.
Aymerick Bazin
Doctorant au LP2N













